外源褪黑素对盐胁迫下金盏菊幼苗生长、光合及生理特性的影响
范海霞 赵飒 李静 辛国奇


摘 要:為探讨褪黑素(melatonine,MT)对盐胁迫下金盏菊幼苗生理机制的影响,采用盆栽砂培法研究不同浓度外源褪黑素(0、50、100、200 μmol/L MT)对不同程度盐胁迫(0、100、200 mmol/L NaCl)下金盏菊幼苗生长、光合作用及生理特性的影响。结果表明,100、200 mmol/L NaCl胁迫严重限制了金盏菊幼苗的生长,叶绿素含量、光化学荧光效率及光合作用强度降低,MDA、H2O2含量升高加剧了脂质过氧化程度,诱导POD酶活性升高的氧化应激反应及脯氨酸含量增加。经外源褪黑素处理能有效缓解盐胁迫对金盏菊幼苗的伤害,其中100 μmol/L MT处理下株高、茎围、地上部和根系干重较对照分别平均提高了17.35%、17.64%、32.14%和19.83%;叶绿素含量和Fv/Fm增幅分别达71.96%和4.13%,光合作用参数Pn、Gs和Tr平均分别提高了88.74%、97.21%和58.88%,而Ci降幅达18.07%;MDA和H2O2含量降幅达33.77%和64.29%,POD、CAT酶活性及可溶性蛋白、脯氨酸含量平均分别提高了118.02%、67.29%、55.47%和56.30%。盐胁迫条件下,MT处理能有效提高抗氧化酶活性及降低脂质过氧化水平,促进可溶性蛋白和脯氨酸积累,改善光合荧光特性,最终表现为促进金盏菊幼苗生长。
关键词:褪黑素;盐胁迫;金盏菊幼苗;光合作用;生理特性
中图分类号:S681.7 文献标识码:A
Abstract:
To explore the effect of melatonine (MT) on the physiological mechanism of Calendula officinalis seedlings under salt stress, a pot-sand culture method was used to study different concentrations of exogenous melatonin (0, 50, 100, 200 μmol/L MT) effects on the growth, photosynthesis and physiological characteristics of C. officinalis seedlings under different levels of salt stress (0, 100, 200 mmol/L NaCl). The results showed that 100 and 200 mmol/L NaCl stress severely restricted the growth of C. officinalis seedlings, reduced chlorophyll content, photochemical fluorescence efficiency and photosynthesis intensity. The content of MDA and H2O2 increased, which intensified the degree of lipid peroxidation, induced POD enzyme activity and proline content increased. Treatment with exogenous melatonin could effectively alleviate the damage of salt stress to marigold seedlings. The plant height, stem circumference, shoot and root dry weight under 100 μmol/L MT treatment increased by 17.35%, 17.64%, 32.14% and 19.83%, respectively com-pared with the control. Chlorophyll content and Fv/Fm increased by 71.96% and 4.13%, respectively. The photosynthesis parameters Pn, Gs and Tr increased by 88.74%, 97.21% and 58.88%, respectively, while Ci decreased by 18.07%. The content of MDA and H2O2 reduced by 33.77% and 64.29%, POD, CAT enzyme activity, soluble protein, and proline content increased by 118.02%, 67.29%, 55.47% and 56.30%. Under salt stress conditions, MT treatment could effectively increase the activity of antioxidant enzymes and reduce the level of lipid peroxidation, promote the accumulation of soluble protein and proline, improve photosynthetic fluorescence characteristics, and ultimately promote the growth of C. officinalis seedlings.
Keywords:
melatonine; salt stress; Calendula officinalis seedlings; photosynthesis; physiological characteristics
DOI:
10.3969/j.issn.1000-2561.2021.05.018
土壤盐渍化是限制干旱及半干旱地区作物生长的重要因素之一。随着全球气候变化加剧,土壤盐渍化治理及作物耐盐碱性研究日益成为我国生态环境治理及作物生产力提高的研究热点[1-2]。盐胁迫条件下,植物内部组织细胞过氧化氢(hydrogen peroxide,H2O2)、单线态氧(singlet oxygen,1O2)、羟基自由基(hydroxyl radical,OH-)等过氧化产物浓度增加,破坏植物细胞脂质和核酸分子,影响植物光合生理代谢,抑制植物生长[3-4]。植物为了适应盐胁迫条件,形成了自身独特的生理调节机制,其中抗氧化酶系统和渗透调节就是植物本身为适应环境而形成的重要生理机能。植物依赖以过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)等抗氧化酶为代表的抗氧化酶系统缓解盐胁迫造成的植物细胞内活性氧(reactive oxygen species,ROS)等高反应活性的自由基过度积累[5-6]。盐胁迫环境下,植物细胞内新陈代谢过程被诱导改变,植物自身通过提高并积累脯氨酸、可溶性蛋白等渗透调节物质以促进植物细胞对水分的摄取能力,从而应对盐胁迫影响[7]。
褪黑激素(melatonine,MT),又名N-乙酰基-5-甲氧基色胺,是一种重要的外源性植物生长调节剂,在植物种子生根发芽、营养和生殖生长等关键生长发育过程中发挥重要作用[8-9]。研究表明,褪黑素是一种较小的两亲化合物,通过进入细胞内细胞核和线粒体,参与调节植物生长和抗逆性,褪黑素在提高植物对盐碱、干旱、重金属、高温、紫外线辐射等多种胁迫的抵抗能力方面发挥显著作用[10-12]。研究表明,外源褪黑素能够缓解干旱胁迫引起的苹果叶片衰老,并且有效改善光合作用[13]。外源褪黑素發挥缓解植物非生物胁迫作用可能与抗氧化酶活性的增强有关。Liu等[14]研究表明,外源褪黑素处理显著增强了胁迫条件下番茄幼苗的光合作用和抗氧化能力。在拟南芥上的研究发现,外源褪黑素通过增加抗氧化酶基因表达和抗氧化酶活性,以缓解盐胁迫造成的氧化损伤[15]。
金盏菊(Calendula officinalis)属菊科金盏菊属植物,是早春园林和城市中最常见的草本花卉之一。目前关于金盏菊的研究多集中在栽培技术[16]、施肥管理[17]、病虫害防治[18]和药用价值[19]等方面,而在金盏菊的耐盐及外源调控耐盐性方面鲜有报道。鉴于此,本研究以金盏菊幼苗为材料,研究外源褪黑素对不同程度盐胁迫下金盏菊幼苗生长、光合作用和生理特性的影响,探讨褪黑素提高金盏菊幼苗耐盐性的适宜浓度及生理机制,以期为金盏菊品种选育及土壤盐渍化区域合理应用与栽培推广提供参考。
1 材料与方法
1.1 材料
试验用金盏菊(Calendula officinalis)种子由许昌市林业科学研究所提供,品种为卡布劳纳(kablouna)。试验于2019年8月在许昌职业技术学院内进行。挑选优质饱满种子,消毒浸种后播种于石英砂穴盘中。金盏菊种子播种后于温室中栽培管理,待幼苗生长至四叶一心时期,移植于营养钵中培育,每钵1株。期间浇灌1/2霍格兰营养液,培养条件设置为昼(14 h/30 ℃)、夜(10 h/20 ℃),光照强度约1 200~1 500 μmol/m2·s,相对湿度50%~65%。待幼苗生长至六叶一心时,开始试验处理。
试验设置3级盐胁迫程度分组,分别浇灌含有0、100、200 mmol/L NaCl的霍格兰营养液。处理前期,盐胁迫程度以50 mmol/L每天递增,直至到预定浓度,然后每天按预定浓度浇灌一次,处理液浇灌量为持水量的3倍,约2/3的溶液流出,从而将以前的积余盐冲洗掉,以保持NaCl浓度恒定。在每级盐胁迫分组,喷施4个浓度(0、50、100、200 μmol/L)褪黑素溶液处理金盏菊幼苗,从第一次开始每隔5 d喷施一次,以叶面湿露不滴水为准。试验共12个处理,每个处理重复3次,每个重复15株幼苗。处理21 d后取样测定金盏菊幼苗生长参数,取不同处理金盏菊幼苗中部功能叶片进行生理指标的测定。
1.2 方法
1.2.1 生长指标测定 幼苗用蒸馏水冲洗干净,用直尺和游标卡尺测定幼苗的株高和茎围。将地上部和根系分开,置于105 ℃下杀青30 min,后在80 ℃洁净烘箱烘干至恒重,使用精密天平称量其干物质量。根冠比=根系干重/地上部干重。
1.2.2 叶片光合荧光指标测定 采用95%乙醇提取测定叶片叶绿素a和叶绿素b含量,总叶绿素=叶绿素a+叶绿素b[20]。使用便携式荧光测定仪(PAM- 2100,德国Walz)测定叶绿素荧光PSⅡ最大光化学效率(Fv/Fm)。使用便携式光合测定系统(LI-6400XT,美国LI-COR)测定叶片净光合速率(photosynthetic,Pn)、气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate,Tr)和胞间CO2浓度(intercellular CO2 concentration,Ci)等光合作用参数。
1.2.3 叶片生理指标测定 参照李合生等[21]的方法,采用硫代巴比妥酸法(thiobarbituric acid,TBA)测定丙二醛(malondialdehyde,MDA)含量;参照林植芳等[22]的方法,测定叶片过氧化氢(H2O2)含量;参照王学奎等[20]的方法,采用愈创木酚法测定过氧化物酶(POD)活性。采用紫外吸收法测定过氧化氢酶(CAT)活性;可溶性蛋白的含量采用考马斯亮蓝G-250染色法进行测定;脯氨酸的含量采用酸性茚三酮法进行测定。
1.3 数据处理
采用Excel 2010和SPSS 21.0软件进行数据统计分析,采用Origin 9.0进行分析绘图,对平均值用Duncans新复极差法进行多重比较。
2 结果与分析
2.1 不同处理对幼苗生长参数的影响
不同处理对盐胁迫下金盏菊幼苗生长参数的影响如表1所示。在没有施用外源褪黑素处理中,金盏菊幼苗株高、茎围、地上部干重和根系干重表现出随盐胁迫水平的升高而逐渐降低的趋势,而根冠比有所升高,特别是200 mmol/L盐胁迫处理下金盏菊幼苗株高、茎围、地上部干重和根系干重较0 mmol/L盐胁迫处理分别降低了14.31%、7.28%、22.79%和17.95%,而根冠比增加了8.42%,说明盐胁迫限制了金盏菊幼苗的正常生长。在不同程度盐胁迫处理下,施用不同浓度外源褪黑素处理均能促进金盏菊幼苗生长,具体表现为100 μmol/L MT>50 μmol/L MT>200 μmol/L MT。与0 μmol/L MT处理相比,100 μmol/L MT处理下金盏菊幼苗在不同程度盐胁迫处理下株高、茎围、地上部干重和根系干重平均分别提高了17.35%、17.64%、32.14%和19.83%,而根冠比平均降低了23.34%,且两褪黑素浓度处理在不同盐胁迫水平下差异均显著(P<0.05)。以上分析可以看出,盐胁迫严重抑制了金盏菊幼苗的生长,而通过外源施用不同浓度褪黑素处理能有效提高幼苗各项生长参数,其中以100 μmol/L MT处理对促进盐胁迫下金盏菊幼苗生长效果最好。
2.2 不同处理对幼苗叶绿素含量和荧光的影响
由图1可知,随着盐胁迫程度的提高,未施用外源褪黑素处理下金盏菊幼苗叶绿素含量及最大光化学效率Fv/Fm均呈现逐渐降低的趋势。与0 mmol/L盐胁迫处理相比,200 mmol/L盐胁迫处理下幼苗叶绿素含量及最大光化学效率Fv/Fm分别降低了50.21%和3.05%,说明盐胁迫造成金盏菊幼苗叶片光合色素含量及光化学荧光效率降低。在不同程度盐胁迫处理下,不同浓度外源褪黑素处理均能提高金盏菊幼苗叶片叶绿素含量及最大光化学效率Fv/Fm,与0 μmol/L MT处理相比,50 μmol/L MT、100 μmol/L MT及200 μmol/L MT处理下金盏菊幼苗叶绿素含量及最大光化学效率Fv/Fm平均分别提高了38.73%和3.26%、71.96%和4.13%、26.04%和1.98%。在不同浓度褪黑素处理之间,100 μmol/L MT处理在不同程度盐胁迫处理下金盏菊幼苗叶片叶绿素含量均显著高于50 μmol/L MT及200 μmol/L MT处理(P<0.05),而在最大光化学效率Fv/Fm方面,200 mmol/L盐胁迫处理条件下100 μmol/L MT处理下金盏菊幼苗最大光化学效率Fv/Fm显著高于其他两褪黑素浓度处理(P<0.05)。从以上分析可以看出,盐胁迫导致金盏菊幼苗叶绿素及光化学荧光受损,通过施用不同浓度外源褪黑素能不同程度提高及改善金盏菊幼苗叶绿素含量及荧光,其中以100 μmol/L MT处理效果最佳。
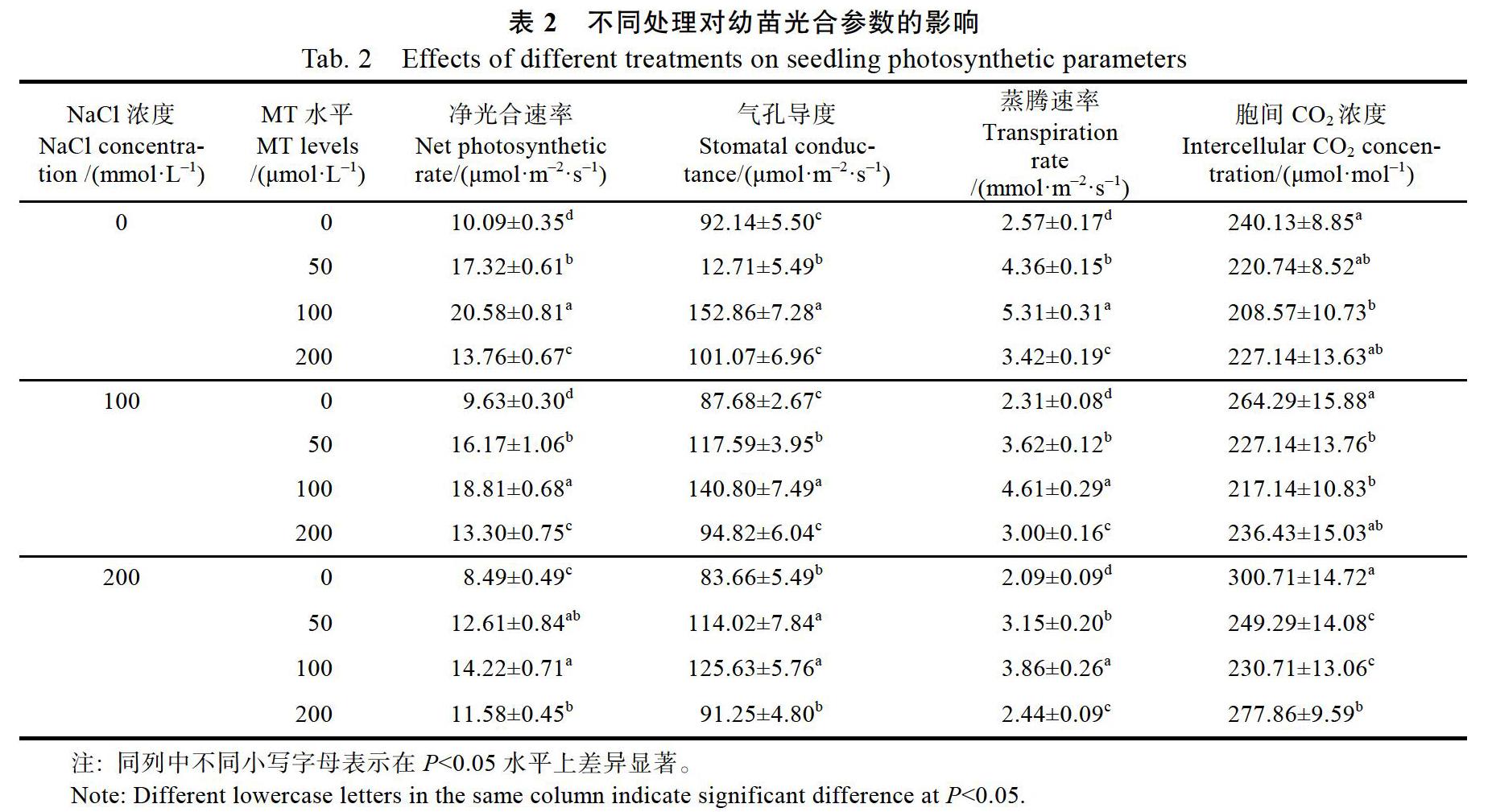
2.3 不同处理对幼苗光合参数的影响
不同处理对盐胁迫下金盏菊幼苗光合作用参数的影响如表2所示。随着盐胁迫水平的升高,在没有施用外源褪黑素处理中,金盏菊幼苗叶片Pn、Gs和Tr表现出逐渐降低的趋势,而胞间CO2浓度Ci有所升高,其中200 mmol/L盐胁迫处理下金盏菊幼苗Pn、Gs和Tr较0 mmol/L盐胁迫处理分别降低了15.91%、18.55%和9.21%,而Ci增加了25.30%,说明盐胁迫下金盏菊幼苗叶片光合作用能力受到限制。在不同程度盐胁迫处理下,施用不同浓度外源褪黑素处理均能有效改善金盏菊幼苗叶片光合及CO2同化能力,具体表现为100 μmol/L MT>50 μmol/L MT>200 μmol/L MT。与0 μmol/L MT处理相比,100 μmol/L MT处理下金盏菊幼苗在不同程度盐胁迫处理下Pn、Gs和Tr分别平均提高了88.74%、97.21%和58.88%,而Ci平均降低了18.07%,且两褪黑素濃度处理在不同盐胁迫水平下差异均显著(P<0.05)。在不同浓度褪黑素处理之间,100 mmol/L盐胁迫处理条件下100 μmol/L MT处理金盏菊幼苗叶片Pn、Gs和Tr亦显著高于50 μmol/L MT和200 μmol/L MT处理。以上分析可以看出,盐胁迫严重抑制了金盏菊幼苗叶片的光合作用能力,而通过外源施用不同浓度褪黑素处理能有效改善幼苗各项光合作用参数以提高光合作用强度,其中以100 μmol/L MT处理最好。
2.4 不同处理对幼苗MDA和H2O2含量的影响
由图2可知,随着盐胁迫程度的提高,未施用外源褪黑素处理下金盏菊幼苗MDA和H2O2含量均呈现逐渐升高的趋势。与0 mmol/L盐胁迫处理相比,100 mmol/L和200 mmol/L盐胁迫处理下幼苗MDA和H2O2含量分别升高了26.32%和47.89%、63.75%和132.68%,说明盐胁迫造成金盏菊幼苗叶片细胞过氧化程度增加。在不同程度盐胁迫处理下,不同浓度外源褪黑素处理均能降低金盏菊幼苗叶片MDA和H2O2含量,与0 μmol/L MT处理相比,50、100及200 μmol/L MT处理下金盏菊幼苗MDA和H2O2含量平均分别降低了27.83%和42.72%、33.77%和64.29%、12.01%和24.78%。在不同浓度褪黑素处理之间,0及200 mmol/L盐胁迫处理条件下100 μmol/L MT处理下金盏菊幼苗MDA含量显著低于其他两褪黑素浓度处理(P<0.05),100 μmol/L MT处理在不同程度盐胁迫处理下金盏菊幼苗H2O2含量均显著低于50及200 μmol/L MT处理(P<0.05)。从以上分析可以看出,盐胁迫导致金盏菊幼苗叶片细胞脂质过氧化程度增加,通过施用不同浓度外源褪黑素能不同程度降低盐胁迫下细胞内MDA和H2O2含量以缓解细胞脂质过氧化对金盏菊幼苗的伤害,其中以100 μmol/L MT处理对降低盐胁迫下金盏菊幼苗MDA和H2O2含量效果最好。
2.5 不同处理对幼苗POD和CAT酶活性的影响
由图3可知,在未施用外源褪黑素处理条件下,随着盐胁迫程度的提高,金盏菊幼苗POD酶活性逐渐降低,而CAT酶活性呈现先升高后降低的趋势。与0 mmol/L盐胁迫处理相比,100 mmol/L和200 mmol/L盐胁迫处理下幼苗POD酶活性分别降低了38.22%和60.19%,而CAT酶活性分别升高了24.39%和17.88%,说明盐胁迫对金盏菊幼苗造成胁迫伤害,同时金盏菊幼苗通过自身抗氧化酶系统调节抗氧化酶活性以协调过氧化的伤害。在不同程度盐胁迫处理下,不同浓度外源褪黑素处理均能提高金盏菊幼苗POD和CAT酶活性,与0 μmol/L MT处理相比,50 μmol/L MT、100 μmol/L MT及200 μmol/L MT处理下金盏菊幼苗POD和CAT酶活性平均分别提高了69.97%和36.93%、118.02%和67.29%、47.79%和28.43%。在不同浓度褪黑素处理之间,100 μmol/L MT处理在不同程度盐胁迫处理下金盏菊幼苗POD和CAT酶活性均显著高于50 μmol/L MT及200 μmol/L MT处理(P<0.05)。从以上分析可以看出,施用不同浓度外源褪黑素能不同程度提高金盏菊幼苗在盐胁迫下抗氧化酶活性,其中以100 μmol/L MT处理对提高盐胁迫下金盏菊幼苗POD和CAT酶活性效果最好。
2.6 不同处理对幼苗可溶性蛋白和脯氨酸含量的影响
由图4可知,随着盐胁迫程度的提高,在未施用外源褪黑素处理条件下金盏菊幼苗可溶性蛋白含量逐渐降低,而脯氨酸含量逐渐升高。与0 mmol/L盐胁迫处理相比,100 mmol/L和200 mmol/L盐胁迫处理下幼苗可溶性蛋白含量分别降低了15.17%和24.83%,而脯氨酸含量分别升高了18.87%和109.08%。在不同程度盐胁迫处理下,不同浓度外源褪黑素处理均能提高金盏菊幼苗可溶性蛋白和脯氨酸含量,与0 μmol/L MT处理相比,50 μmol/L MT、100 μmol/L MT及200 μmol/L MT处理下金盏菊幼苗可溶性蛋白和脯氨酸含量分别平均提高了43.82%和29.39%、55.47%和56.30%、26.10%和11.79%。在不同浓度褪黑素处理之间,0 mmol/L盐胁迫处理条件下100 μmol/L MT处理金盏菊幼苗可溶性蛋白含量显著高于其他两褪黑素浓度处理(P<0.05),100 mmol/L盐胁迫处理条件下100 μmol/L MT处理金盏菊幼苗可溶性蛋白含量显著高于200 μmol/L MT处理,而在200 mmol/L盐胁迫处理条件不同褪黑素浓度处理间差异不显著(P>0.05)。100 mmol/L及200 mmol/L盐胁迫处理条件下,100 μmol/L MT处理金盏菊幼苗脯氨酸含量显著高于其他两褪黑素浓度处理(P<0.05)。整体来看,以100 μmol/L MT处理对提高盐胁迫下金盏菊幼苗可溶性蛋白和脯氨酸含量效果最好。
3 讨论
盐胁迫下植物生理生化代谢过程受到影响,植物通过主动或被动的形态调节可以提高对胁迫环境的适应性[23]。本试验中,盐胁迫降低了金盏菊幼苗的株高、茎围、地上部干重和根系干重等形态指标,而根冠比有所提高,这与前人关于盐胁迫下金盏菊幼苗生长的研究结果相一致[24]。外源施用不同浓度褪黑素能促进金盏菊幼苗生长,尤其是100 μmol/L褪黑素处理下对盐胁迫下金盏菊幼苗生长形态参数改善最为显著,这可能与褪黑素能够促进生长细胞分裂以及提高生长素、赤霉素等植物激素水平有关[25]。据报道,褪黑素能够调节细胞壁延伸的物理过程以诱导植物根系生长,在胁迫环境中相对旺盛生长的根系吸水能力提高并促进了植株生长[26]。另外,褪黑素对盐胁迫下金盏菊幼苗生长的促进作用可能与提高了叶片的光合作用效率有很大关系[27],这在本試验中对金盏菊幼苗光合及荧光特性的研究中也得到了验证(图1和表2)。
植物叶绿素含量及光合荧光特性是反映光合作用进程及有机物质转化积累的重要参数。在盐胁迫条件下,叶绿素合成受阻以及酶促作用导致分解加快,导致植物叶片叶绿素含量降低以致影响光合作用的正常进行[28]。研究表明,应用外源褪黑素处理可能抑制盐胁迫造成的叶绿素降解酶活性的增强,或者促进参与叶绿素生物合成的δ氨基乙酰丙酸和原叶绿素酸酯还原酶复合体的合成,从而提高了植物叶片叶绿素含量[29]。本试验中,金盏菊幼苗叶片最大光化学效率Fv/Fm随盐胁迫程度的增加而降低,而外源褪黑素的施用明显增加了叶片光化学效率(图1B),且以100 μmol/L褪黑素处理效果最好。盐胁迫条件下金盏菊幼苗叶片Fv/Fm的降低表明PSⅡ中QA到QB的电子迁移受到抑制,实际光能转换效率大大降低[30]。本试验中,外源施用褪黑素下金盏菊幼苗Fv/Fm有所提高,说明褪黑素处理有助于维持较高的荧光电子传递效率及缓解PSⅡ反应中心被破坏程度,提高盐胁迫条件下PSⅡ光化学效率来提高叶片光合能力,这与前人的研究结果一致[31]。
本试验中,盐胁迫造成金盏菊幼苗叶片Pn、Tr和Gs降低,而Ci升高(表2),说明盐胁迫导致光合作用生理过程紊乱。研究表明,盐胁迫下细胞过氧化破坏了叶绿体亚显微结构,使光化学过程中电子传递受阻,影响类囊体蛋白质合成和参与卡尔文循环的相关酶活性,最终导致植物叶片气孔导度降低、CO2同化缓慢、叶片蒸腾速率和光合速率下降等问题[32]。施用不同浓度褪黑素,盐胁迫下金盏菊幼苗光合作用参数明显改善,这可能是由于叶片光合色素含量增加,同时植株根系旺盛生长的同时促进了地上部茎叶的生长,光合作用性能得到改善[33]。也有报道指出,褪黑素可作为抗氧化剂介入植物对干旱胁迫引起的过氧化防御体系,保护叶绿体和光合作用机构,提高光合作用能力[34]。
盐胁迫下植物生成过量活性氧自由基,损伤细胞质膜并破坏正常的生理生化代谢,同时植物通过抗氧化酶防御系统等机制应对过氧化胁迫[35]。丙二醛(MDA)是表征细胞膜脂质过氧化的重要指标,H2O2含量亦是常用来判断细胞过氧化程度的重要指标[36]。本实验中,金盏菊幼苗叶片MDA和H2O2含量随盐胁迫程度的增加而提高,说明胁迫下脂质过氧化严重破坏了细胞膜的完整性和稳定性。经外源褪黑素处理,MDA和H2O2含量由不同程度降低,100 μmol/L褪黑素处理下含量最低,表明褪黑素可以作为抗氧化剂,遏制盐胁迫导致的过量自由基积累对细胞的毒性作用[37]。本实验中,盐胁迫对金盏菊幼苗造成胁迫伤害,同时金盏菊幼苗通过自身抗氧化酶系统调节CAT和POD抗氧化酶活性以协调过氧化的伤害(图3)。通过外源施用褪黑素能够介导调节牡丹幼苗叶片抗氧化酶活性,其中以100 μmol/L 褪黑素处理下对提高盐胁迫下金盏菊幼苗POD和CAT酶活性效果最好。研究发现,胁迫条件下植物MDA和H2O2含量的增加与POD和CAT等抗氧化酶活性的降低有很大关系,导致OH·无法得到有效清除,以致MDA和H2O2含量大量积累[38]。因此,经外源褪黑素处理下金盏菊幼苗POD和CAT抗氧化酶活性显著提高,相应的叶片中MDA和H2O2含量降低,这在本试验中得到了验证(图2和图3)。
渗透调节是植物为了应对胁迫环境而进化的生理机制之一。研究发现,处于盐胁迫和水分胁迫中植物叶片普遍出现可溶性蛋白含量降低的情况[39],这也与本试验得到的结果一致。本试验中金盏菊幼苗叶片可溶性蛋白含量随盐胁迫水平的增加而降低,通过外源施用褪黑素能显著增加蛋白质含量缓解盐胁迫对金盏菊幼苗的影响(图4A)。研究发现,盐胁迫下植物叶片可溶性蛋白减少可能与涉及到蛋白质合成的相关酶变性以及氨基酸含量降低有关,而褪黑素能够提高相关蛋白质代谢酶活性,从而促进可溶性蛋白合成[35]。试验中发现,盐胁迫水平的提高会增加金盏菊幼苗叶片中脯氨酸含量,而通过外源施用褪黑素进一步提高了叶片中脯氨酸的积累(图4B),这与前人的研究结果有一致的表现[40-41]。本试验中经外源褪黑素处理叶片渗透调节物质含量提高表明,经外源褪黑素处理的牡丹幼苗具有较高的渗透调节能力,缓解干旱胁迫造成的伤害。
综上所述,盐胁迫严重抑制了金盏菊幼苗的生长,施用外源褪黑素能有效促进金盏菊幼苗对盐胁迫的适应性,且以100 μmol/L褪黑素处理效果最好。盐胁迫条件下,通过外源褪黑素处理能有效提高金盏菊幼苗叶片抗氧化酶活性及降低脂质过氧化水平,促进可溶性蛋白和脯氨酸等渗透调节物质积累,同时保持较高的光合色素含量及改善光合荧光特性,最终表现为促进盐胁迫下金盏菊幼苗生长。
参考文献
[1] Sim L L, Chambers J M, Davis J A. Ecological regime shifts in salinised wetland systems. I. Salinity thresholds for the loss of submerged macrophytes[J]. Hydrobiologia, 2006, 573(1):
89-107.
[2] 高 帆, 謝 玥, 沈妍秋, 等. 外源褪黑素对氯化钠胁迫下美味猕猴桃实生苗抗氧化物酶和渗透调节物质的影响[J]. 浙江农林大学学报, 2018, 35(2):
291-297.
[3] 胡楚琦, 刘金珂, 王天弘, 等. 三种盐胁迫对互花米草和芦苇光合作用的影响[J]. 植物生态学报, 2015, 39(1):
92-103.
[4] Zhang S H, Xu X F, Sun Y M, et al. Influence of drought hardening on the resistance physiology of potato seedlings under drought stress[J]. Journal of Integrative Agriculture, 2018, 17(2):
336-347.
[5] Mashilo J, Odindo A O, Shimelis H A, et al. Photosynthetic response of bottle gourd [Lagenaria siceraria, (Molina) Standl] to drought stress:
Relationship between cucurbitacins accumulation and drought tolerance[J]. Scientia Horticulturae, 2018(231):
133-143.
[6] Swann A L S. Plants and drought in a changing climate[J]. Current Climate Change Reports, 2018, 4(2):
192-201.
[7] 卞凤娥, 肖秋红, 郝桂梅, 等. 根施褪黑素对NaCl胁迫下葡萄内源褪黑素及叶绿素荧光特性的影响[J].中国农业科学, 2018, 51(5):
952-963.
[8] Zhang H M, Zhang Y. Melatonin:
A well-documented anti-oxidant with conditional pro-oxidant actions[J]. Journal of Pineal Research, 2014, 57(2):
131-146.
[9] Janas K M, Ma?gorzata M P. Melatonin, an underestimated natural substance with great potential for agricultural appli-cation[J]. Acta Physiologiae Plantarum, 2013, 35(12):
3285-3292.
[10] 朱金方, 劉京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报, 2015, 35(15):
5140-5146.
[11] Reiter R, Tan D X, Zhou Z, et al. Phytomelatonin:
Assisting plants to survive and thrive[J]. Molecules, 2015, 20(4):
7396-7437.
[12] Khana M N, Zhang J, Luo T. Seed priming with melatonin coping drought stress in rapeseed by regulating reactive oxygen species detoxification:
Antioxidant defense system, osmotic adjustment, stomatal traits and chloroplast ultra-structure perseveration[J]. Industrial Crops & Products, 2019(140):
1-11.
[13] Wang P, Sun X, Li C, et al. Long-term exogenous applica-tion of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research, 2013(54):
292-302.
[14] Liu J, Wang W, Wang L, et al. Exogenous melatonin im-proves seedling health index and drought tolerance in toma-to[J]. Plant Growth Regul, 2015, 77(3):
317-326.
[15] Chen Z, Gu Q, Yu X, et al. Hydrogen peroxide acts down-stream of melatonin to induce lateral root formation[J]. An-nals of Botany, 2018, 121(6):
1127-1136.
[16] 王利芬, 孔丛玉, 吴思琳, 等. 2种菊科植物对镉胁迫的生长和生理响应[J]. 江苏农业科学, 2019, 47(22):
164-166.
[17] 郝 丹, 张 璐, 孙向阳, 等. 园林废弃物堆肥和牛粪有机肥用于金盏菊育苗的研究[J]. 西北林学院学报, 2019, 34(4):
150-155.
[18] 马亚云, 张 帆, 王 甦, 等. 功能植物金盏菊对七星瓢虫温室定殖控害的增效作用研究[J]. 环境昆虫学报, 2019, 41(2):
276-282.
[19] 赵 婷, 国大亮, 刘 洋, 等. 金盏菊活性成分及药理作用研究概况[J]. 中医药导报, 2020, 26(5):
118-121.
[20] 王学奎, 黄建良. 植物生理生化实验原理与技术[M]. 北京:
高等教育出版社, 2015.
[21] 李合生, 孙 群, 赵世杰. 植物生理生化实验原理和技术[M]. 北京:
高等教育出版社, 2000.
[22] 林植芳, 李双顺, 林桂珠, 等. 衰老叶片和叶绿体中H2O2的累积与膜脂过氧化的关系[J]. 植物生理学报, 1988(1):
16-22.
[23] Javadi T, Rohollahi D, Ghaderi N, et al. Mitigating the ad-verse effects of drought stress on the morpho-physiological traits and anti-oxidative enzyme activities of Prunus avium through β-amino butyric acid drenching[J]. Scientia Horti-culturae, 2017(218):
156-163.
[24] Chaparzadeh N, Amico M L, Nejad R K, et al. Antioxidative responses of Calendula officinalis under salinity condi-tions[J]. Plant Physiology and Biochemistry, 2004, 42(9):
695-701.
[25] Muhammad A S R, Muhammad F S, Muhammad Y A, et al. Glycinebetaine applied under drought improved the physio-logical efficiency of wheat (Triticum aestivum L.) plant[J]. Soil & Environment, 2012, 31(1):
67-71.
[26] Sarropoulou V N, Therios I N, Dimassi T, et al. Melatonin promotes adventitious root regeneration in in vitro shoot tip explants of the commercial sweet cherry rootstocks CAB-6P[J]. Journal of Pineal Research, 2012, 52(1):
38-46.
[27] 偶 春, 张 敏, 姚侠妹, 等. 褪黑素对盐胁迫下香椿幼苗生长及离子吸收和光合作用的影响[J]. 西北植物学报, 2019, 39(12):
2226-2234.
[28] 李红杰. 外源褪黑素和硅对盐胁迫下芹菜幼苗生长及生理特性的影响[J]. 河南农业科学, 2020, 49(1):
96-102.
[29] Movahed N, Eshghi S, Jamali B, et al. Ameliorative effects of paclobutrazol on vegetative and physiological traits of grapevine cuttings under water stress condition[J]. Acta Horticulturae, 2012(931):
475-483.
[30] Shu S, Yuan LY, Guo SR, et al. Effects of exogenous sper-mine on chlorophyll fluorescence, antioxidant system and ultrastructure of chloroplasts in Cucumis sativus L. under salt stress[J]. Plant Physiology and Biochemistry, 2013(63):
209-216.
[31] Liu J L, Wei X. Exogenous melatonin improves seedling health index and drought tolerance in tomato[J]. Plant Growth Regulation, 2015, 77(3):
317-326.
[32] 寇江涛. 外源2,4-表油菜素内酯对盐胁迫下燕麦种子萌发抑制的缓解效应[J]. 草业科学, 2020, 37(5):
916-925.
[33] 熊 毅, 熊艳丽, 杨晓鹏, 等. 外源褪黑素对盐胁迫下老化燕麦种子萌发及幼苗的影响[J]. 中国草地学报, 2020, 42(1):
7-14.
[34] Li H, Chang J J, Chen H J, et al. Exogenous melatonin con-fers salt stress tolerance to watermelon by improving photosynthesis and redox homeostasis[J]. Frontiers in Plant Science, 2017(8):
295-298.
[35] 张环纬, 陈 彪, 温心怡, 等. 外源硅对干旱胁迫下烟草幼苗生长、叶片光合及生理指标的影响[J]. 生物技术通报, 2019, 35(1):
17-26.
[36] Kocheva K, Lambrev P, Georgiev G, et al. Evaluation of chlorophyll fluorescence and membrane injury in the leaves of barley cultivars under osmotic stress[J]. Bioelectrochemistry, 2004, 63(1/2):
121-124.
[37] Wang P, Sun X, Li C, et al. Long-term exogenous applica-tion of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research, 2013, 54(3):
292-302.
[38] Liting W, Lina W, Yang Y, et al. Abscisic acid enhances tolerance of wheat seedlings to drought and regulates tran-script levels of genes encoding ascorbate-glutathione bio-synthesis[J]. Frontiers in Plant Science, 2015(6):
458-467.
[39] Parida A K, Das A B. Salt tolerance and salinity effects on plants:
review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3):
324-349.
[40] Roychoudhury A, Basu S, Sengupta D N. Amelioration of salinity stress by exogenously applied spermidine or sper-mine inthree varieties of indica rice differing in their level of salt tolerance[J]. Journal of Plant Physiology, 2011, 168(4):
317-328.
[41] Duan J, Juan L, Shirong G, et al. Exogenous spermidine affects polyamine metabolism in salinity-stressed Cucumis sativus roots and enhances short-term salinity tolerance[J]. Journal of Plant Physiology, 2008, 165(15):
1620-1635.
責任编辑:白 净
猜你喜欢 生理特性盐胁迫光合作用 琅琊榆生理特性及苗木培育技术现代农业科技(2017年8期)2017-06-10花生金属蛋白酶家族基因FtsH的鉴定、分类和盐胁迫表达分析江苏农业科学(2016年12期)2017-04-05NaCl胁迫对牛角瓜种子萌发及幼苗生理特性的影响广西农学报(2016年3期)2017-02-06海拔对丹参苗期生理特性及农艺性状的影响江苏农业科学(2016年4期)2016-06-14家居布艺的光合作用Coco薇(2016年5期)2016-06-03盐胁迫对绿豆种子萌发的影响世纪之星·交流版(2016年1期)2016-04-20例析净光合作用相关题型解题中的信息提取错误与矫正考试周刊(2016年6期)2016-03-11爱上光合作用少儿科学周刊·儿童版(2015年10期)2015-11-074个烟草品种干旱胁迫下萌发和苗期生理特性及抗旱性评价江苏农业科学(2015年5期)2015-10-20盐胁迫下2种樱桃砧木的生理变化江苏农业科学(2015年8期)2015-09-10