α-氮化硅对硅磷酸钙生物陶瓷力学强度和生物活性的影响
贺博 王宁 邓繁艳 富灵杰 宁聪琴



摘 要:
理想的骨再生材料需要具有良好的生物活性和力学强度.前期的研究表明硅磷酸钙(Ca5(PO4)2SiO4,CPS)陶瓷具有良好的生物活性,可诱导骨髓基质干细胞的成骨分化,并在体内可促进新骨的形成.研究了α-氮化硅(α-Si3N4)对CPS生物陶瓷显微结构、抗弯强度、体外磷灰石形成能力及细胞相容性的影响.结果表明:α-Si3N4的添加可在一定程度上提高CPS生物陶瓷的抗弯强度,当其质量分数为1.5%时,Si3N4-CPS陶瓷的抗弯强度为相同温度下纯CPS陶瓷的1.2倍.模拟体液浸泡实验表明:Si3N4-CPS生物陶瓷均具有良好的磷灰石形成能力.CCK-8细胞相容性实验结果表明:Si3N4-CPS生物陶瓷无明显细胞毒性,展示出良好的生物相容性.
关键词:
硅磷酸钙(CPS); α-氮化硅(α-Si3N4); 抗弯强度; 磷灰石形成能力; 生物相容性
中图分类号:
O 611.6 文献标志码:
A 文章编号:
1000-5137(2021)06-0688-09
Abstract:
Ideal bone regeneration materials should have good biological activity and mechanical strength. Previous studies have shown that silicocarnotite (Ca5(PO4)2SiO4, CPS) bioceramic has good biological activity, which can induce osteogenic differentiation of bone marrow matrix stem cells and promote the formation of new bones in vivo. This paper investigated the effects of α-silicon nitride (α-Si3N4) on microstructure, bend strength, apatite forming ability and cytocompatibility of CPS bioceramic. The results show that the addition of α-Si3N4 can improve the bending strength of CPS bioceramic to some extent, and when its mass fraction is 1.5 %, the bending strength of Si3N4-CPS ceramic is 1.2 times of that of pure CPS ceramic at the same sintering temperature. The simulation body fluid immersion experiment shows that Si3N4-CPS bioceramic has good apatite forming ability. The experimental results of CCK-8 cytocompatibility test show that Si3N4-CPS bioceramic has no obvious cytotoxicity, exhibiting a good biocompatibility.
Key words:
silicocarnotite(CPS); α-silicon nitride (α-Si3N4); bending strength; apatite formation ability; biocompatibility
0 引 言
生物陶瓷是修复和重建患病或受损骨组织的常用材料[1].在过去的几十年里,磷酸钙类生物陶瓷,如羟基磷灰石(Ca10(PO4)6(OH)2,HA)陶瓷和磷酸钙(Ca3(PO4)2,TCP)陶瓷,因其良好的生物相容性和骨传导性,成为最受欢迎的人工骨材料[2].20世纪70年代初,CARLISLE[3]发现了硅(Si)是骨钙化的重要因素,MOTISUKE等[4]也发现含Si的生物玻璃具有良好的生物活性,其在生理溶液中具有优异的诱导骨状磷灰石形成的能力,在体内可诱导新骨的生成,并与周围宿主组织形成骨性结合.自此,含Si的生物玻璃和生物陶瓷得到了特别的关注[5-6].为了结合TCP陶瓷和Si元素的优点,有研究将Si掺入磷酸钙陶瓷中,制备了掺硅磷酸钙(CPS)陶瓷,如Si-HA和Si-TCP,Si的掺入可明显促进间充质干细胞的细胞增殖和成骨分化[7].
作为含Si的磷酸钙陶瓷,具有正交結构的Ca5(PO4)2SiO4材料近年来受到了关注.BALAS等[8]利用四水合硝酸钙(Ca(NO3)2·4H2O)、磷酸(H3PO4)和二氧化硅(SiO2)溶胶分别作为钙(Ca)、磷(P)和Si源得到了纯CPS.此外,有报道将磷酸钙/硅酸钙(Ca3(PO4)2/Ca2SiO4)为反应原料制备出了纯相CPS粉体,发现模拟体液(SBF)浸泡后有磷灰石生成,说明其具有良好的体外磷灰石沉积能力[9].在其他合成方法中,BULINA等[10]利用机械化学合成的方法,制备出了CPS粉体.在CPS材料的晶体结构方面,ANDREEV等[11]也对其进行固态核磁共振和计算的研究.本课题组前期利用溶胶-凝胶法合成了纯相CPS粉体,发现与HA陶瓷相比,CPS陶瓷具有更好的生物活性,不仅具有良好的磷灰石形成能力,还能显著促进大鼠骨髓干细胞(rBMSC)的成骨分化[12-13],且在体内亦具有更好的成骨活性和可降解性,植入12周后,CPS材料降解率可达41.8%[14].由于Si的加入,CPS支架具有较好的体内降解能力,同时Ca和P组分的降解可为新骨的生长提供Ca和P的来源,从而加速骨再生过程[12,15].此外,将CPS粉体植入腱-骨伤口处的实验还表明,其可以明显促进腱-骨愈合过程[16].然而,溶胶-凝胶法制备的CPS粉体烧结性能差,导致其力学强度低,从而限制其进一步临床转化.
氮化硅(Si3N4)是一种以高性能著称的结构陶瓷,其具有高断裂韧性、高耐磨性和低摩擦系数.GUEDES等[17]将Si3N4片植入到兔子的股骨中,发现无不良细胞反应发生,并证明了其与周围骨组织有良好的界面结合.且Si3N4也被发现能上调成骨细胞的代谢活性[18].将Si3N4用作β-CaSiO3陶瓷的烧结助剂,发现添加Si3N4后β-CaSiO3陶瓷的弯曲强度得到了显著提升[19].AMARAL等[20]对Si3N4-生物玻璃复合材料进行生物学评价发现,该复合物不仅能促进人骨髓细胞的增殖和分化,还有助于材料实现更快的骨整合.
为了提高CPS材料的力学强度和生物活性,本文作者引入了具有良好力学特性的Si3N4材料来调控CPS的综合性能,探究α-氮化硅(α-Si3N4)的添加对CPS生物陶瓷的力学强度和生物活性的影响.
1 实验部分
1.1 材料的制备与表征
CPS粉体制备:采用Ca(NO3)2·4H2O(分析纯,上海凌峰化学试剂集团公司)、磷酸三乙酯(TEP,化学纯,上海凌峰化学试剂集团公司)和正硅酸乙酯(TEOS,分析纯,上海凌峰化学试剂集团公司)分别作为Ca源、P源和Si源.合成步骤简述如下:将适量的TEOS在室温下与一定量2 mol·L-1硝酸、去离子水和无水乙醇搅拌1 h,使其充分水解,之后按化学计量比加入TEP,搅拌2 h后加入Ca(NO3)2·4H2O继续搅拌3 h,使其完全溶解,得到澄清的溶胶,随后置于60 ℃烘箱陈化3 d,再在120 ℃烘箱中干燥得到干凝胶.将干凝胶研磨筛分后于1 350 ℃下煅烧6 h得到CPS粉体,过200目筛备用.
Si3N4-CPS陶瓷制备:所用α-Si3N4粉体(α相质量分数≥92%,平均粒径约为420 nm)采购自江苏安塞美新能源科技有限公司.将α-Si3N4粉体按照0,0.5%,1.0%,1.5%(质量分数)的比例与上述制备得到的CPS粉体采用机械球磨的方法混合(以下简称CPS,0.5 Si3N4-CPS,1.0 Si3N4-CPS,1.5 Si3N4-CPS).将混合粉体压制成块状(21 mm×27 mm×6 mm)和圆片状(直径为10 mm,厚度为2 mm)试样,在253 MPa压力下等静压处理,随后在1 300 ℃烧结2 h,并随炉冷却.
1.2 相成分及显微结构表征
用X射线衍射仪(XRD, Rigaku, Ultima IV)检测原材料粉体及Si3N4-CPS陶瓷的物相组成.测试时选用Cu Kα射线(波长为1.541 8×10-10 m),步长0.02°,扫描速度5(°)·min-1,扫描范围20°~50°.
用场发射扫描电子显微镜(FE-SEM,Magellan 400,FEI)观察原材料及Si3N4-CPS陶瓷的的形貌,并利用其配备的能谱仪对Si3N4-CPS陶瓷的成分进行分析.
所制备的CPS粉体和采购的α-Si3N4粉体的物相和形貌,分别如图1和图2所示.由图1可见,所制备的CPS粉体物相与PDF#40-0393相吻合,无明显杂相衍射峰.由图2可见,其形貌为不规则的颗粒状,α-Si3N4粉体物相与PDF#09-0250符合良好,尺寸较为均匀.
1.3 抗弯强度测试
抗弯强度采用三点弯曲法在万能材料试验机(Instron-5566,Instron Co., Ltd.)上进行测定.样品尺寸为3.0 mm×4.0 mm×21.0 mm,力学测试底座跨度为16.0 mm,十字头下降速度为0.5 mm·min-1,每组5个平行样品.
1.4 开孔气孔率测定
用阿基米德排水法进行测定Si3N4-CPS陶瓷的开孔孔隙率.样品的开孔气孔率(S值)可表示为:
S=(m_2-m_1)/(m_2-m_3)×100%, (1)
其中,m1,m2和m3分别是样品的干重、湿重和浮重.
1.5 SBF浸泡实验
材料在SBF中诱导磷灰石沉积的能力经常被用来表征其体外生物活性.SBF的配制过程严格遵从 KOKUBO等[21]的方法,配置过程如下:将氯化钠(NaCl)、碳酸氢钠(NaHCO3)、氯化钾(KCl)、磷酸氢二钾(K2HPO4·3H2O)、氯化镁(MgCl2·6H2O)、氯化钙(CaCl2)、硫酸钠(Na2SO4)依次溶解在去离子水中,并用三羟甲基氨基甲烷(NH2C(CH2OH)3)和0.1 mol·L-1的鹽酸调节溶液的pH值,使溶液在37 ℃时pH值为7.40,然后用容量瓶定容,低温保存.
浸泡前,将制备的圆片状样品先后用无水乙醇和去离子水超声清洗2遍,烘干后置15 mL的离心管中,按照陶瓷片表面积和SBF体积比为0.1 cm-1的比例,添加配制的SBF溶液后置于37 ℃的恒温水浴振荡箱中.分别在浸泡1,3和7 d后收集浸泡样品后的SBF,并用电感耦合等离子体原子发射光谱仪(ICP-OES Agilent 725, Agilent Technologies)测定其Ca,P和Si元素的浓度.浸泡7 d后,取出样品,并用去离子水轻轻洗涤,60 ℃烘箱中干燥后用FE-SEM观察其浸泡前后表面形貌和成分变化.
1.6 细胞相容性表征
将Si3N4-CPS陶瓷研磨,并过200目筛后加入50 mL离心管中,然后添加α-MEM培养基(200 mg·mL-1),之后在37 ℃恒温振荡箱中浸泡24 h.浸泡后的混合液经离心机1 600 r·min-1分离10 min,收集上层清液,并经0.22 μm过滤器过滤消毒后,加入10%(质量分数)胎牛血清(FBS,Gibco),100 U·mL-1的青霉素和100 U·mL-1的链霉素混合均匀待用.
采用Cell Counting Kit-8(CCK-8,Biotech)实验来评估材料的细胞相容性.所用的细胞为小鼠成骨细胞MC3T3-E1(上海第九人民医院).按每孔100 μL MC3T3-E1细胞悬浮液(3.0×104 cell·mL-1)的量将细胞接种到96孔培养板中,然后在含有5%(质量分数)二氧化碳(CO2)的培养箱中培养24 h,换用已制备好的浸提液继续培养细胞,期间每2 d更换一次培养液.在培养不同时间后,用酶标仪(Leica)分别测量溶液在450 nm和630 nm处的吸光度值(OD).
实验结果采用平均值±标准差的方法表示,使用SPSS软件和Graphpad Prism软件进行统计学误差分析.当显著性值(P值)小于0.05时,认为有统计学差异;当P值小于0.01时,认为有极顯著的差异.
2 结果与讨论
2.1 Si3N4-CPS陶瓷的相成分、显微结构及其烧结性能
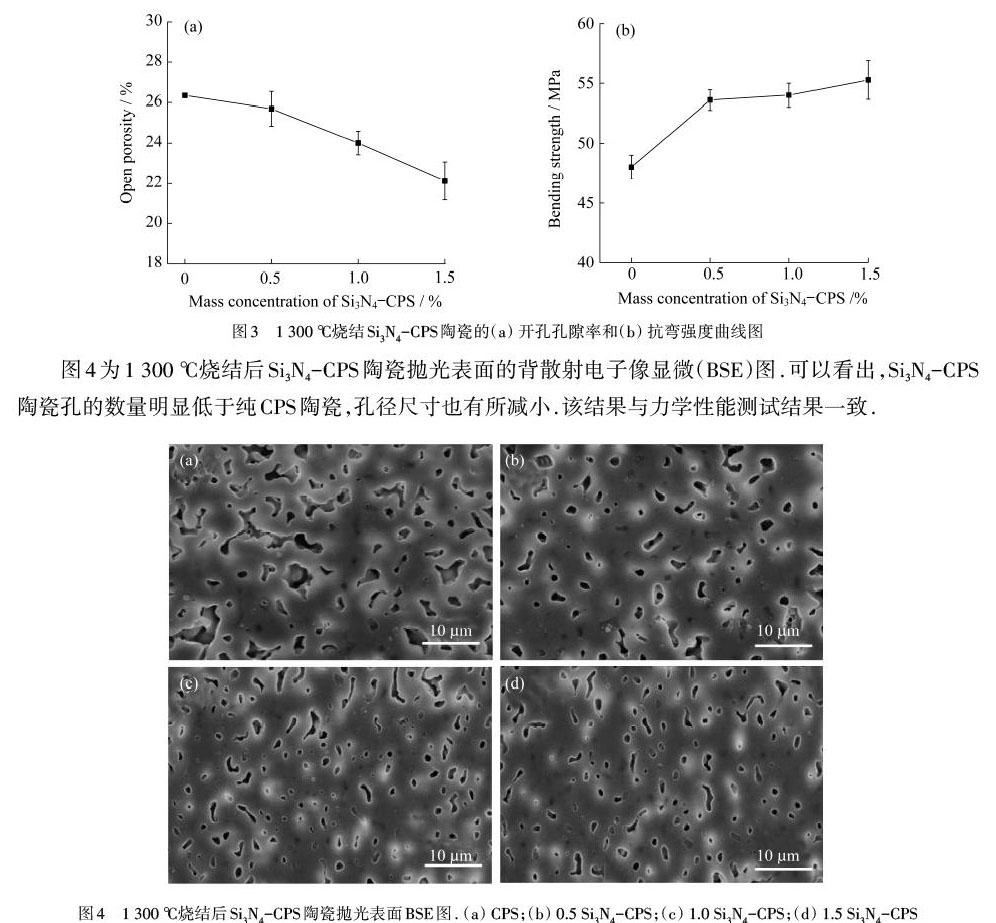
1 300 ℃烧结后的Si3N4-CPS陶瓷P值和抗弯强度随Si3N4含量变化趋势如图3所示.可以看出,随着Si3N4含量的增加,Si3N4-CPS陶瓷的P值降低,抗弯强度增加,这说明Si3N4的加入可促进CPS陶瓷的烧结.从图3(a)可以发现,当Si3N4的含量从0增加到1.5%(质量分数)时,其开孔孔隙率从26.2%下降到22.3%,其抗弯强度由47.5 MPa增加到55.2 MPa.1.5 Si3N4-CPS陶瓷烧结后的抗弯强度最高,可达55.2 MPa,是相同温度下纯CPS陶瓷抗弯强度的1.2倍左右,如图3(b)所示.
图4为1 300 ℃烧结后Si3N4-CPS陶瓷抛光表面的背散射电子像显微(BSE)图.可以看出,Si3N4-CPS陶瓷孔的数量明显低于纯CPS陶瓷,孔径尺寸也有所减小.该结果与力学性能测试结果一致.
Si3N4-CPS陶瓷在1 300 ℃下烧结2 h后的XRD结果如图5所示.可以发现:Si3N4-CPS陶瓷在高温烧结后,其主相依旧是CPS,随着Si3N4含量的增加,XRD图中未发现Si3N4或其他杂相的存在.
为研究Si3N4-CPS陶瓷在高温烧结后的相组成,选择在1 300 ℃下烧结后的0.5 Si3N4-CPS陶瓷样品,对其抛光后进行元素面扫分析,分析结果如图6所示.由图6可知,Ca,P,O和N元素分布较为均匀,但有富Si相的存在,结合之前DENG等[22]的工作,可以推测此富Si相为硅酸钙.但由于其含量较低,在XRD结果中,并未检测到硅酸钙的衍射峰.
2.2 Si3N4-CPS陶瓷体外磷灰石沉积能力
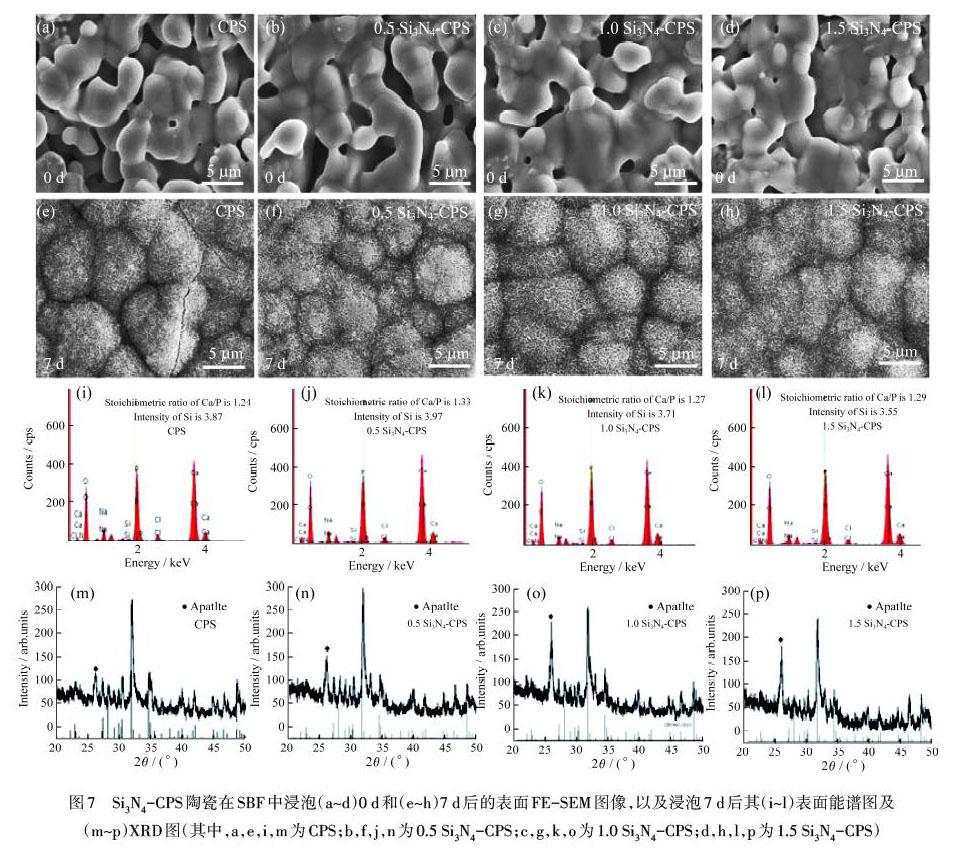
图7为浸泡前后的Si3N4-CPS陶瓷片在FE-SEM下的表面形貌、元素含量和物相分析结果.从图7(a)-7(d)可知,浸泡前Si3N4-CPS陶瓷片的表面较为疏松,有大量的孔洞存在,表面晶粒干净且光滑.随着Si3N4含量的增加,烧结后的Si3N4-CPS陶瓷在一定程度上显示出致密化的趋势.图7(e)-7(h)结果表明:在SBF中浸泡7 d后,Si3N4-CPS陶瓷表面与纯CPS陶瓷表面一致,均覆盖了一层连续且致密的沉积物.对沉积物进一步放大观察发现,表面沉积物主要由蠕虫状的晶粒构成,为典型的类骨磷灰石形貌.
图7(i)-7(l)和图7(m)-7(p)为用SBF浸泡7 d后的Si3N4-CPS陶瓷表面能谱分析和XRD结果.能谱结果表明:Si3N4-CPS陶瓷表面形成的是一种缺钙形磷灰石,其Ca和P的化学计量比在1.2~1.3左右.此外,随着Si3N4含量的增加,能谱结果显示出Si含量在一定程度上降低,这反映了Si3N4的添加能进一步促进CPS陶瓷表面沉积磷灰石的能力.XRD结果表明:浸泡后的Si3N4-CPS陶瓷的物相结晶性减弱,在26°出现了磷灰石的特征衍射峰,且随着Si3N4含量的增加,此峰强度逐渐增加,进一步说明Si3N4的掺杂提高了CPS陶瓷的磷灰石形成能力.可见,相比于纯CPS,Si3N4-CPS陶瓷具有更好的体外生物活性.
图8(a)-8(c)为Si3N4-CPS陶瓷圆片浸泡在SBF中Ca,P和Si的元素质量分数变化曲线.采用赵迎珂[23]的方法来计算元素总释放量.在浸泡第一天,各组Si的质量分数迅速增大,Ca的质量分数下降,P的质量分数基本不变,在之后的浸泡过程中,Si的质量分数持续增大,Ca的质量分数持续下降,而P的质量分数则呈一定程度的下降趋势.如图8(c)所示,1.0 Si3N4-CPS与1.5 Si3N4-CPS两组收集液中Si的质量分数要低于其他两组.参考磷灰石晶核成形-晶体生长的理论[24-25],Si3N4-CPS陶瓷浸泡SBF后,表面磷灰石沉积的过程是新相生成并不断长大的过程,在浸泡时,Si从CPS陶瓷中溶解释放到周围的溶液中.同时,在材料表面形成大量Si-OH,这些Si-OH为磷灰石提供了有利的成核位点,并进一步吸收周围环境中的钙离子(Ca2+)、磷酸根离子(PO43-)和氢氧根离子(OH-)而形成磷灰石层.
2.3 Si3N4-CPS陶瓷体外细胞相容性
Si3N4-CPS陶瓷颗粒浸提液细胞增殖水平的CCK-8检测结果如图9所示.在每个检测时间点,各组之间细胞增殖的结果规律性不明显.但可以发现:随着培养时间的增加,每组细胞的相对数量都逐渐增加,这表明所有的Si3N4-CPS陶瓷均具有良好的细胞相容性.
3 结 论
本工作采用生物相容性良好的α-Si3N4作为添加剂,以改善Ca5(PO4)2SiO4生物陶瓷的力学强度和生物活性.结果表明:α-Si3N4的添加能有效改善溶胶-凝胶法制备的CPS粉体的烧结性能.1.5%(质量分数) Si3N4-CPS在1 300 ℃烧结后的最高弯曲强度是纯CPS陶瓷的1.2倍左右.此外,SBF浸泡实验表明:α-Si3N4的加入能进一步促进CPS陶瓷表面磷灰石的形成,预示其具有良好的体外生物活性.细胞相容性结果也表明:Si3N4-CPS陶瓷具有良好的细胞相容性以及成为骨再生材料的潜力.
参考文献:
[1] HABIBOVIC P, BARRALET J E. Bioinorganics and biomaterials:
bone repair [J]. Acta Biomaterialia,2011,7(8):3013-3026.
[2] MOTISUKE M, CARRODEGUAS R G, ZAVAGLIA C A C. Si-TCP synthesized from “Mg-free” reagents employed as calcium phosphate cement [J]. Materials Research,2012,15(4):568-572.
[3] CARLISLE E M. Silicon:
a possible factor in bone calcification [J]. Science,1970,167(3916):279-280.
[4] MOTISUKE M, MESTRES G, RENO C O, et al. Influence of Si substitution on the reactivity of α-tricalcium phosphate [J]. Materials Science and Engineering:
C,2017,75(6):816-821.
[5] ZHAI W, LU H, WU C, et al. Stimulatory effects of the ionic products from Ca-Mg-Si bioceramics on both osteogenesis and angiogenesis in vitro [J]. Acta Biomaterialia,2013,9(8):8004-8014.
[6] LUGO G J, MAZON P, DE AZA P N. Phase transitions in single phase Si-Ca-P-based ceramic under thermal treatment [J]. Journal of the European Ceramic Society,2015,35(13):3693-3700.
[7] DELGSDO-RUIZ R A, CALVO G J L, ROMNBOS G E. Bone grafting materials in critical defects in rabbit calvariae:
a systematic review and quality evaluation using ARRIVE guidelines [J]. Clinical Oral Implants Research,2018,29(6):
620-634.
[8] BALAS F, PEREZ-PARIENTE J, VALLET-REGI M. In vitro bioactivity of silicon-substituted hydroxyapatites [J]. J Biomed Mater Res A,2003,66(2):364-375.
[9] SERENA S, CABALLERO A, DE AZA P N, et al. New evaluation of the in vitro response of silicocarnotite monophasic material [J]. Ceramics International,2015,41(8):9411-9419.
[10] BULINA N V, CHAIKINA M V, GERASIMOV K B, et al. A novel approach to the synthesis of silicocarnotite [J]. Materials Letters,2016,164(2):255-259.
[11] ANDREEV A S, BULINA N V, CHAIKINA M V, et al. Solid-state NMR and computational insights into the crystal structure of silicocarnotite-based bioceramic materials synthesized mechanochemically [J]. Solid State Nuclear Magnetic Resonance,2017,84:151-157.
[12] LU W, DUAN W, GUO Y, et al. Mechanical properties and in vitro bioactivity of Ca5(PO4)2SiO4 bioceramic [J]. Journal of Biomaterials Applications,2012,26(6):637-650.
[13] PENG L, NING C, DING D, et al. Mechanical properties and protein adsorption of Ca5(PO4)2SiO4 bioceramics sintered from solid state reaction derived powders [J]. Journal of Biomaterials and Tissue Engineering,2015,5(2):
162-168.
[14] 段偉. Ca5(PO4)2SiO4生物活性材料的成骨性能研究 [D]. 上海:
中国科学院上海硅酸盐研究所,2012.
DUAN W. Research on osteogenic properties of Ca5(PO4)2SiO4 bioactive materials [D]. Shanghai:Shanghai Institute of Ceramics, Chinese Academy of Sciences,2012.
[15] DUAN W, NING C Q, TANG T T. Cytocompatibility and osteogenic activity of a novel calcium phosphate silicate bioceramic:
silicocarnotite [J]. Journal of Biomedical Materials Research Part A,2013,101(7):1955-1961.
[16] ZHAO S, ZHAO J. Effect of BFGF-loaded Ca5(PO4)2SiO4 bioceramic on tendon-to-bone healing after repair of chronic rotator cuff tear [J]. Asia-Pacific Journal of Sports Medicine, Arthroscopy, Rehabilitation and Technology,2017,9(1):26.
[17] GUEDES E S C C, KONIG J B, CARBONARI M J, et al. Tissue response around silicon nitride implants in rabbits[J]. Journal of Biomedical Materials Research Part A,2008,84(2):337-343.
[18] PEZZOTTI G, OBA N, ZHU W, et al. Human osteoblasts grow transitional Si/N apatite in quickly osteointegrated Si3N4 cervical insert [J]. Acta Biomaterialia,2017,64:411-420.
[19] PAN Y, ZUO K, YAO D, et al. The improved mechanical properties of β-CaSiO3 bioceramics with Si3N4 addition [J]. Journal of the Mechanical Behavior of Biomedical Materials,2016,55:120-126.
[20] AMARAL M, COSTA M A, LOPES M A, et al. Si3N4-bioglass composites stimulate the proliferation of MG63 osteoblast-like cells and support the osteogenic differentiation of human bone marrow cells [J]. Biomaterials,2002,23(24):4897-4906.
[21] KOKUBO T, TAKADAMA H. How useful is SBF in predicting in vivo bone bioactivity [J]. Biomaterials,2006,27(15):2907-2915.
[22] DENG F, RAO J, NING C. Ferric oxide:
a favorable additive to balance mechanical strength and biological activity of silicocarnotite bioceramic [J]. Journal of the Mechanical Behavior of Biomedical Materials,2020,109:103819.
[23] 趙迎珂. 含钠的生物陶瓷与生物陶瓷复合材料的制备与性能研究 [D]. 上海:
中国科学院上海硅酸盐研究所, 2009.
ZHAO Y K. Research on preparation and properties of sodium-containing bioceramic and bioceramic composites [D]. Shanghai:
Shanghai Institute of Ceramics, Chinese Academy of Sciences,2009.
[24] LIU X, DING C, CHU P K. Mechanism of apatite formation on wollastonite coatings in simulated body fluids [J]. Biomaterials,2004,25(10):1755-1761.
[25] OHTSUKI C, KOKUBO T, YAMAMURO T. Mechanism of apatite formation on CaO-SiO2-P2O5 glasses in a simulated body fluid [J]. Journal of Non-Crystalline Solids,1992,143(5):84-92.
(责任编辑:郁慧,包震宇)
